ABOUT
CPのトランスフェクション技術
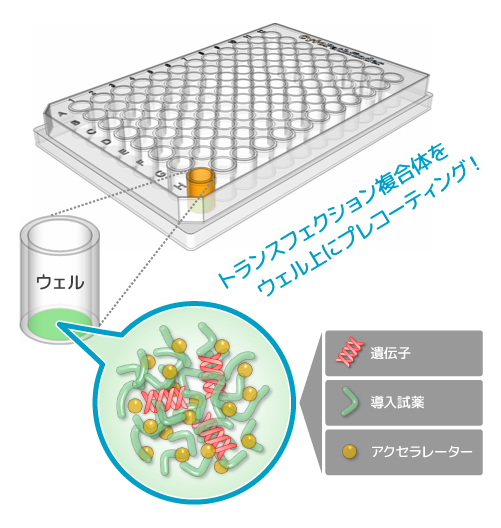
CPのトラスフェクション技術は固相トランスフェクション法に基づいています。固相トランスフェクションでは導入したい遺伝子、導入試薬からなる複合体をあらかじめプレートウェル上に安定に固定化するため、細胞を播種するだけ*1で簡単にトランスフェクションを行えます。固相化されたプレートは長期間の保存もできるため*2、好きなときにトラスフェクションを行うことができます。特許技術・アクセラレーター(遺伝子導入促進剤)は細胞への遺伝子導入効率を高めるため、希少細胞や難しい細胞へのトランスフェクションも適用できる可能性があります。
遺伝子導入効率が高く、操作が簡単なトランスフェクションプレートは再現性の高い実験結果をもたらします。ウェル密度の高いプレートを使えば、ゲノムワイドなスクリーニングも夢ではありません。
従来法との違い
従来法には、プレートで培養した細胞にトランスフェクション複合体を添加するフォワード法と、試薬調製を行った混合試薬を、先に細胞培養プレートに分注し、そこに細胞を播種するリバース法があります。
従来法1:フォワード法
フォワードトランスフェクション法では細胞をプレート上で前培養した後に、トランスフェクション複合体の調製、添加を行う必要があります。この手法は操作が煩雑なため、特に数う多くの検体を処理するときなどでは、再現性の高い結果を得ることは困難となりがちです。またフォワード法では操作手順が複雑なだけでなく、比較的遺伝子導入効率が低いという問題があります。
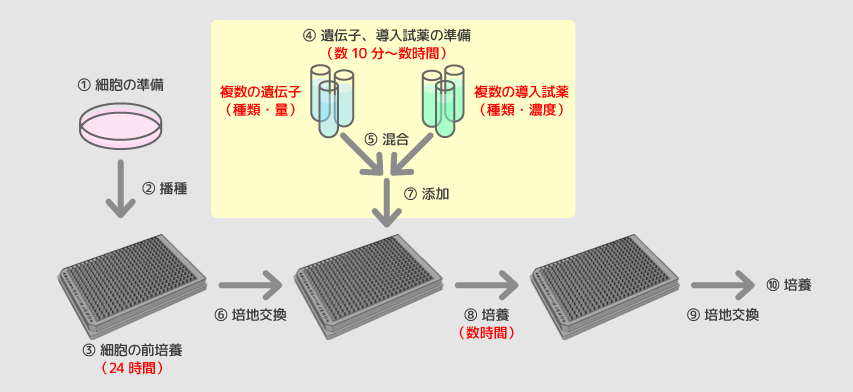
従来法2:リバース法
リバーストランスフェクション法ではトランスフェクション複合体の調製事前に行い、それを培養プレート上に分注したうえで、細胞を後から播種します。フォワード法に比べ遺伝子導入効率は上がる場合が多く、オートメーション化にも向いており、大規模なsiRNAスクリーニングには、通常こちらが用いられることが一般的です。ただし、大きなサイズのライブラリスクリーニングを行うには試薬の用時調製を機械化(リキッドハンドラーや搬送装置などの導入、オペレーション)の必要や、細胞調製と試薬調製をほぼ同時並行的に行う必要があり、細胞調製に失敗した場合(初代培養、細胞調製の失敗、細胞数の不足など)、調製された試薬をロスする可能性があります。
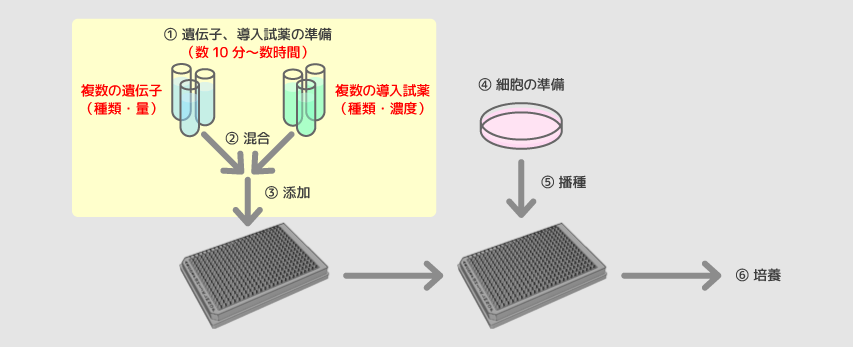
固相法
固相トランスフェクション法は細胞を後から播種するという意味においてリバーストランスフェクション法の一種とみなされます。固相法では、試薬を用時調製する従来の液相法とは異なり、導入したい遺伝子と導入試薬からなる複合体をあらかじめウェル上に安定的に固相化します。固相化されたプレートは保存が可能なため、ユーザー側には、細胞播種以外の複雑な操作手順は必要ありません。このため、大型のリキッドハンドラーや、搬送装置のようなハイスループットスクリーニング(HTS)システムを導入する必要がなく、細胞播種が可能な環境を整えるだけで、HTSが可能になります。
また、試薬の用事調製が不要なため、初代培養などのような場合でも、細胞が播種できる状態になたことを確認してから、保存されたトランスフェクションプレートを取り出し、細胞播種を行うことができます。

CPの固相トランスフェクション法では、遺伝子、導入試薬、アクセラレーターからなる複合体をプレートウェル上に安定に固相化するため、細胞を播種するだけの簡単な操作でトランスフェクションを行うことができます。また特許技術・アクセラレーターにより、従来の液相法よりも高い遺伝子導入効率が期待できます。
CPのトランスフェクションプレートを利用すれば、実験結果の再現性に大きく影響する複雑な操作手順を行うことなく、簡単にさまざまな用途に合ったトランスフェクション実験を行うことができます。
| フォワード法 | リバース法 | 固相法+アクセラレーター | |
|---|---|---|---|
| サンプル調製 | 複雑 | 機械化可能 | 不要(播種するだけ) |
| プレートの保存 | 不可能 | 不可能 | 可能(-20°Cで12ヶ月) |
| 導入効率 | 中程度 | 中程度~高い | リバース法と同等~高い |
| データの再現性 | 低い~中程度 | 高い(機械設定必須) | 高い |
| ライブラリ規模 | 小 | 小~大(機械化が必要) | 小~大 |
希少細胞・難しい細胞への適用
アクセラレーターを用いたCPのトランスフェクション技術は、株化細胞、初代培養細胞、間葉系幹細胞、神経系細胞など、さまざまな細胞に対する固相トランスフェクションを可能としました(実績のある細胞のリストはこちら)。
以下に希少細胞・難しい細胞への適用例をご紹介します。
Primary Normal Human Hepatocytes
希少細胞の一例として、PhoenixBio社のPXBマウス®から得られた初代正常ヒト肝細胞へのトランスフェクション結果を以下にご紹介します。
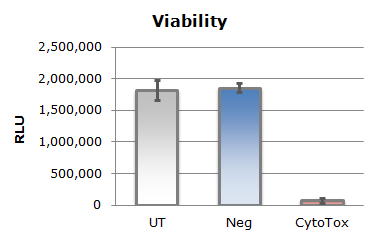
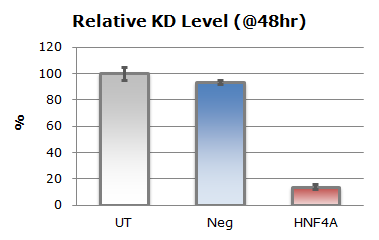
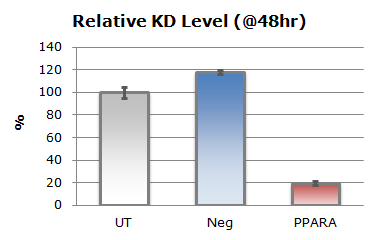
上のグラフ中、UTは無処置群を表し、Negは陰性対照siRNA、CytoToxは細胞死を誘導する陽性対照siRNAです。トランスフェクションによる細胞毒性はほとんど見られず、非常に高い導入効率を達成しました(1-CytoTox/Neg=0.96)。同様にPCRの結果からmRNAのノックダウンレベルは80%以上であることが確認されました。
Jurkat
トランスフェクションの難しい細胞の一例として、浮遊細胞でもあるJurkat(ヒト急性T細胞性白血病細胞由来細胞株)の結果 を以下にご紹介します。
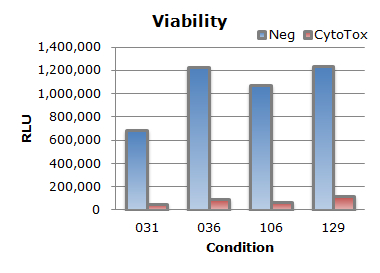
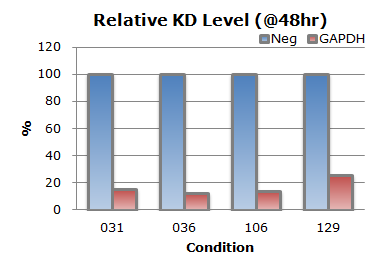
グラフ中のConditionとは最適化キットにおける条件番号です(384ウェルプレートVer.3を使用)。生細胞を測定した結果より、いずれの条件においても細胞死を誘導する陽性対照siRNA(CytoTox)はよく効いており、陰性対照siRNA(Neg)と比較して90%ほどの細胞が死滅しました。またPCRの結果からもノックダウン効率は75~88%の結果が得られました。