ウェルプレートフォーマットに関して
従来の液相トランスフェクション法では、ウェルあたりの細胞数を減らすと遺伝子導入効率が低下するために、ウェルフォーマットとしては、384-wellが限界であると考えられてきましたが、固相トランスフェクション法では高い遺伝子導入効率が得られるため、1536-wellの高密度なウェルフォーマットへの適用することが可能です。さらに、マイクロアレイフォーマットは、長期培養条件での実験に適しており、表現型変化や分化誘導における標的候補分子のシグナル伝達系の時系列解析に対応しております。
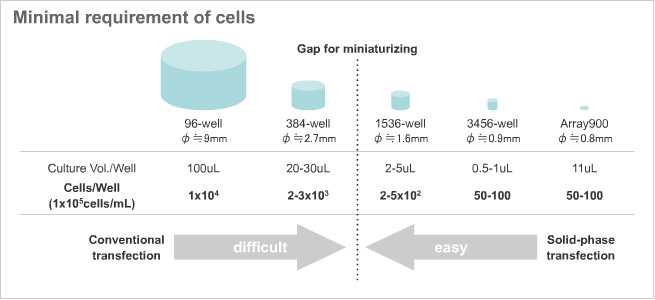
また、近年では新たに胞遺伝子治療など、多くの細胞へのトランスフェクションへのニーズをいただいており、そのような要望に対応すべく、大量に細胞培養が可能な少数、大容量ウェルプレート(~6ウェル)の開発も進めています。
siRNAトランスフェクションプレート
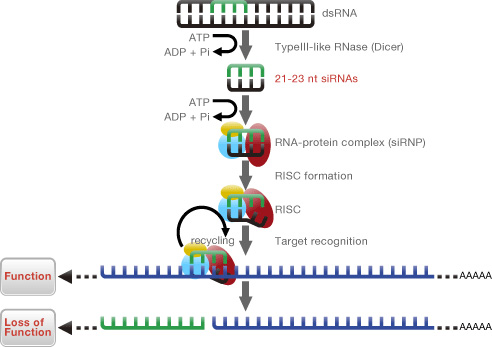
siRNAトランスフェクションプレートは、下図に示すように、細胞内に取り込まれたsiRNAが対応する遺伝子のmRNA配列を切断することで、いわゆるロス・オブ・ファンクション(遺伝子機能の欠失)を惹き起こす現象に基づいています。siRNAを導入した細胞を用いて、薬剤等による刺激から表現型の変化までの間に横たわるブラックボックスを覗くことで細胞内ネットワーク上の関連遺伝子群を網羅的に洗い出すことが可能です。弊社では長年siRNAライブラリーを固相化、スクリーニングを実施してきた実績がございますので、細胞を播種するだけで安定した遺伝子スクリーニング試験を実施していただくことが可能です。
この技術を応用し、現在 フェニックスバイオ株式会社と業務提携契約を締結し、「siRNA導入済みPXB-cells」の販売を開始しております。
プラスミドDNAトランスフェクションプレート
長年弊社はsiRNAトランスフェクションを基盤技術として研究、商品化を進めておりましたが、近年プラスミドDNA導入のニーズが増加しており、プラスミドDNAの導入に固相トランスフェクションを応用する手法を確立しました。プラスミドの遺伝子導入効率は、下図に示す通り、通常の液相法と比較して固相法により飛躍的に高めることが可能です。これにより、プラスミド導入によるゲイン・オブ・ファンクション(遺伝子機能の付加)の試験も可能となり、384-wellプレートでのプラスミドライブラリのスクリーニング試験を実施した実績もございます。
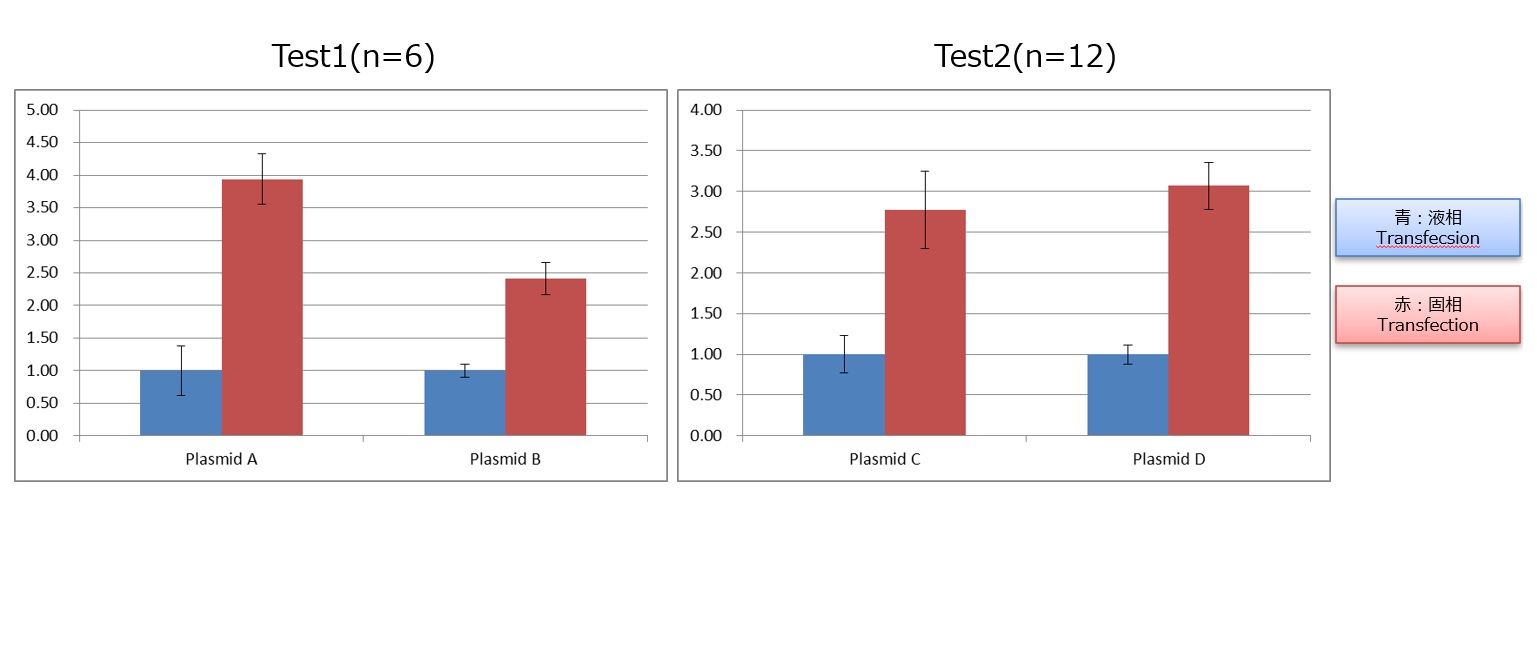
HEK293TにてLuciferase発現プラスミドを液相法と固相法で導入し、導入24時間後のLuciferasse活用を測定。液相法と固相法は同一のプラスミド量、試薬濃度で実施し、液相法の蛍光強度を1として固定法のすうちを計算。
CRISPR-Cas9遺伝子編集プレート
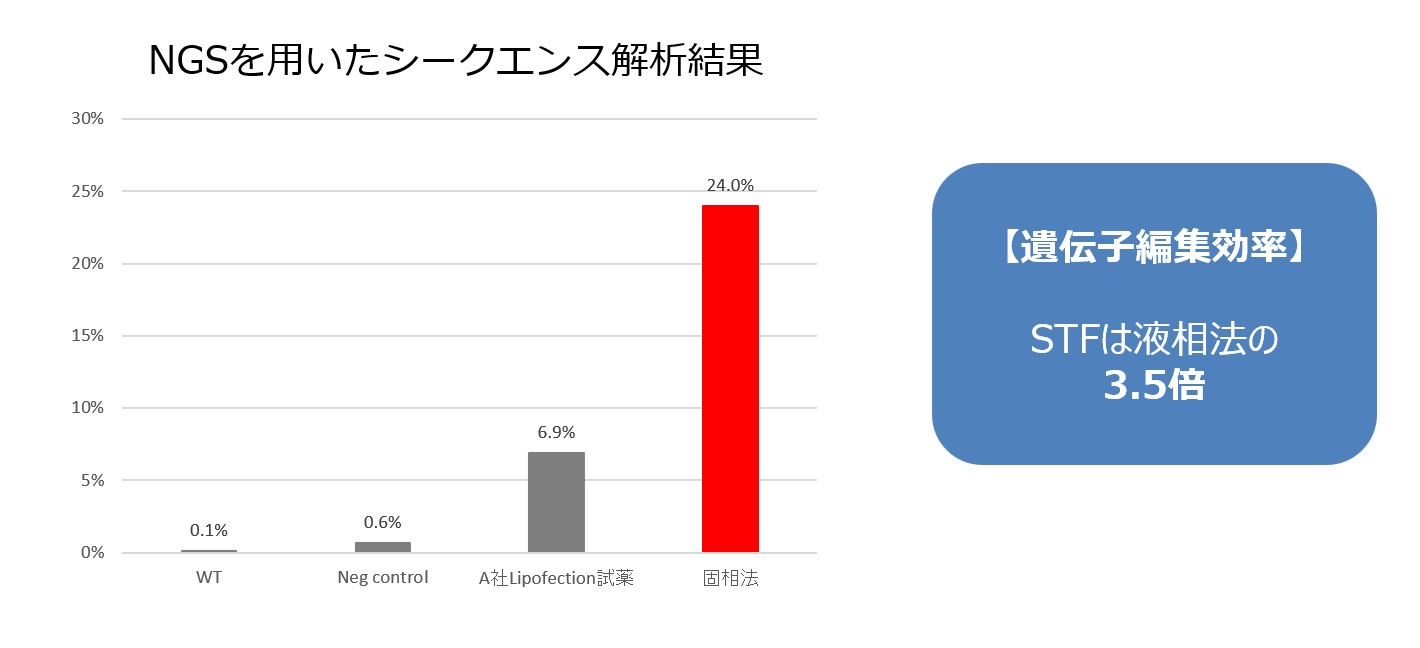
CRISPR-Cas9を用いた遺伝子編集の効率はgRNAターゲット配列が目的の配列を認識して切断する『切断効率』の他に、gRNAの編集する細胞への『導入効率』によっても編集効率が左右されます。gRNAのターゲット配列の設計には切断後に効果的な機能の欠損を誘導できることや、オフターゲットが少ないこと、切断する箇所の塩基などを複合的に考慮するアルゴリズムを用いて設計されることが多く、必ずしも切断効率が高い配列が選定されるとは限りません。そこで、固相化トランスフェクション技術をCRISPR-Cas9に応用し、gRNAの導入効率を高めることによって遺伝子編集の効率を高めることができるか実証試験を行い、通常のリポフェクション法と比較して遺伝子編集効率が大幅に上昇することを確認しました。
Cas9安定発現マウス幹細胞を使用して同一のgRNAを市販の試薬を使用したリポフェクション法と固相法で導入し、次世代シーケンサー(NGS)による配列分析を実施し、遺伝子の編集効率を比較した