基盤技術
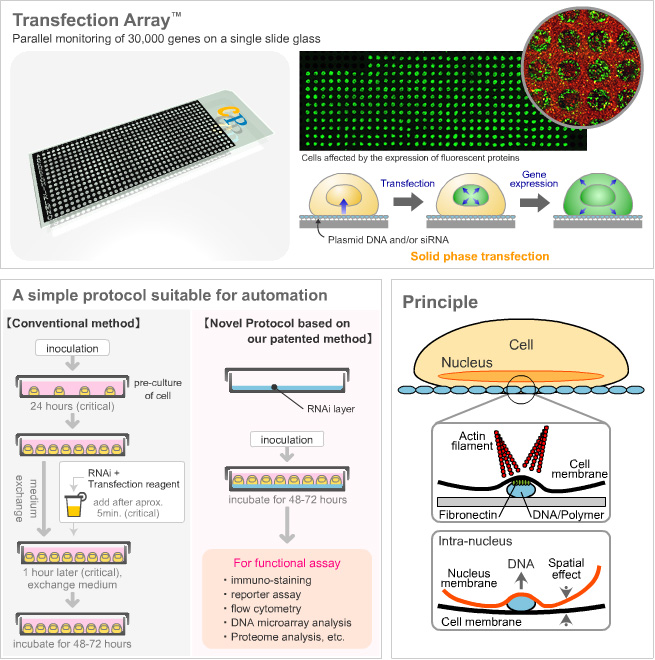
固相トランスフェクションSTFの概要
核酸をガラスアレイ又は細胞培養樹脂プレート上に固相化して、細胞への核酸導入を容易にする技術は、2000年代初頭に弊社創業者の一人である研究者が米国 スクリプス研究所で開発特許化し、その後進化させてきた技術です。それまでになかった革新的な点は、細胞の食作用(エンドサイトーシス)を促進する導入促進剤を見出し固相化技術として特許化したことに始まります。
この技術は一般的な株化細胞だけでなく、遺伝子導入が難しいとされている初代培養細胞・幹細胞など各種細胞にも適用可能です。また、従来は熟練の研究者により容器内/溶液中で核酸導入されていた細胞実験プロセスが、最適配合された核酸とトランスフェクション試薬、更に導入促進剤の複合体が、弊社であらかじめ培養プレート上に自動化装置で固相化処理され、工業的な商品として顧客に納入され、顧客では単に目的の細胞を播種するだけの簡単な作業で正確な実験データが得られるという、従来法と比較して飛躍的に簡易化・効率化した遺伝子導入と細胞培養プロセスを実現しています。
従来の固相トランスフェクションとその課題
従来の液相トランスフェクションでは、細胞をデバイス上で前培養してから、トランスフェクション試薬を添加していました。この手法は操作が煩雑な上、遺伝子導入効率が低いという問題がありました。
そこで、デバイスの固相上に導入する遺伝子を固定化し、その上で細胞を培養するだけでトランスフェクションを行う固相トランスフェクションが開発されてきました。代表的なものに、ウェルフォーマット(Homma Kら BBRC, 2001, 289, 1075-1081) や、マイクロアレイフォーマット(Ziauddin J and Sabatini DM Nature, 2001, 411, 107-110)による固相トランスフェクション技術があります。
しかしながら、これらの方法ではプロトコルは簡便化されたものの、多くの細胞種において遺伝子導入効率が低いという問題が依然として解決されていないため、適用できる細胞種が制限される欠点がありました。
課題解決のための当社技術
当社の創業メンバーである三宅正人(工学博士)は、細胞外マトリクスタンパク質(*)などの「遺伝子導入促進剤」を用いる独自の固相トランスフェクション技術を開発することにより、遺伝子導入効率を飛躍的に高めることに成功しました。
遺伝子導入促進剤の開発により、適用可能な細胞種が広がり、遺伝子導入効率が低くてお悩みの細胞でのトランスフェクション実験を可能にしました。
*細胞外マトリクスタンパク質による遺伝子導入促進作用につきましては、細胞内ストレスファイバー誘引作用が引き金となって、細胞とDNA(RNA)層間の相互作用が増強されるメカニズムによるものと考えられます(Yoshikawa T, et. al., J. Control Release, 2004, 96, 227-232 ; Uchiyama E, et al., Neuroscience Lett., 2005, 378, 40-43)
適用可能な細胞種
遺伝子導入促進剤を用いたトランスフェクション用デバイスである当社の「トランスフェクションアレイ™」は、下表に示されるように株化細胞以外にも、遺伝子導入が難しいとされている初代培養細胞、間葉系幹細胞におけるトランスフェクションを可能としました。
当社では、複数の遺伝子導入促進剤を揃えており、その他の多くの細胞種においても高効率トランスフェクションが可能であると考えております。
また、浮遊細胞に対しても、例えば、Kato Kらにより(Biotechniques, 2004, 37, 444-452)、BAM(Biocompatible anchor for membrane)で修飾したデバイス表面で細胞を保持する方法が開発されており、浮遊細胞株K562 細胞での固相トランスフェクションが確認されております。このことは、当社のトランスフェクションアレイ™が付着細胞だけでなく浮遊細胞にも適用できることを示唆しております。
| Applicable Cells | Source |
| Cell lines | |
| Hela | human cervix carcinoma |
| T-47D | human breast cancer |
| SK-BR-3 | human breast cancer |
| MCF7 | human breast cancer |
| MDA-MB-231 | human breast cancer |
| MDA-MB-453-S | human breast cancer |
| HEK293, 293T | human embryonic kidney |
| Caco2 | adenocarcinoma, colon |
| HepG2 | human hepatocellular carcinoma |
| NT2 (NTERA-2) | human teratocarcinoma |
| SHSY5Y | human neuroblastoma |
| NIH/3T3, 3T3-L1 PC-12 |
mouse embryonic fibroblast rat pheochromocytoma |
| Normal cells | rat brain cortex neuronal cells primary mouse embryonic fibroblast (MEF) |
| Human breast cancer cells | Mice Bearing human tumor xenografts |
| Stem cells | human mesenchymal stem cell (hMSCs) mouse neuronal stem cell |
siRNAトランスフェクションと臨床開発におけるその応用
siRNAトランスフェクション実験は、下図に示すように、細胞内に取り込まれたsiRNAが対応する遺伝子配列を切断することで、いわゆるロス・オブ・ファンクション(遺伝子機能の欠失)を惹き起こす現象に基づいています。この技術は、株化細胞・初代培養細胞・幹細胞など各種の細胞に適用でき、それらの細胞における、薬剤等による刺激から表現型の変化までの間に横たわるブラックボックスを覗くことで細胞内ネットワーク上の関連遺伝子群を網羅的に洗い出します。
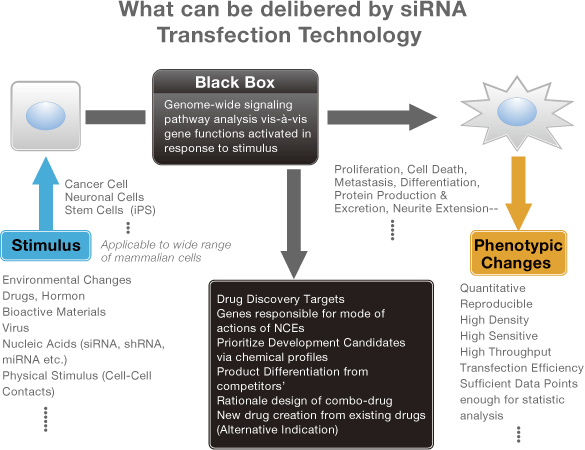
当社のトランスフェクション技術は、以下に示すように医薬品候補の探索研究から臨床開発までの、さまざまなステップで利用することができると考えられます。
- 標的遺伝子の探索と同定
- 細胞内シグナルパスウェイの探索による疾患メカニズムの解明
- 薬剤の作用機序に関わる遺伝子群の探索による、細胞ファーマコゲノミクス(細胞PGx)を用いた臨床試験の成功率の向上
- siRNA医薬(ただし、これまでの臨床試験でも多くの失敗例があり、有効な薬物送達システムDDSの確立が必須)
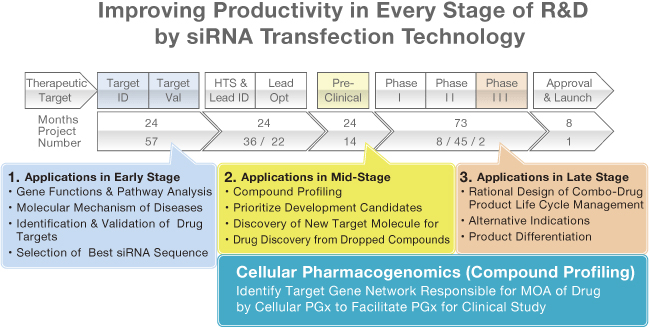
ビジネス上の投資対効果という観点では、3)と4)は製薬産業にとっては低リスクかつ市場への出口に近いため、最も興味のあるところではないかと考えられます。
製薬業界における臨床試験の成功率はそれぞれ、65%(フェーズI)、35%(フェーズII)、60%(フェーズIII)となっており、フェーズIIの成功率が特に低くなっていますが、その失敗の52%(フェーズIIIでは実に72%に上ります)が、「薬効なし」という理由によるものです。この問題に対し、従来のPGxは、医薬品の候補化合物への応答性の違う集団を分類することによって、臨床試験の成功率を改善することを狙っています。
一方、細胞PGxでは、細胞の表現型の変化を定量的に測定することで、候補化合物の薬効に関わる重要な細胞内ネットワークを明らかにすることができます。薬の作用に関わる候補遺伝子群を同定するためには、約2万3000個もの全ゲノム遺伝子から絞り込むところが重要になりますが、こうして選択された候補遺伝子群は、従来の臨床データのPGx解析をより確実で効率的なものにします。
薬の作用に関わる遺伝子ネットワークが解明されると、それらのデータベースを用いて、よりよい治療のための既存薬・新規候補化合物NCEsの併合剤や適応拡大の設計を理論的に行うことが可能となります。
通常、フェーズII臨床試験には18~24ヶ月を要しますが、細胞PGxでは6~12ヶ月で各薬剤の作用機序に関わる遺伝子群を同定できるので、従来の複雑なSNPs解析のみによるPGxをより迅速で簡便なものにするためには、医薬品候補化合物の細胞PGx解析をフェーズIIまたはそれ以前に行うことが効果的であると思われます。
Combination of pharmacogenomics and cellular pharmacogenomics
in Phase-II clinical trial is the key to improve its success rate

Genome-wide PGx depends on the size of well-defined patients population: If the populations is not large enough, readout of signals from the noises is not easy. Biological roles of genes (markers) identified for classification of sub-population are often unclear.
Cellular PGx can narrow down the gene network responsible for MOA of drug by silencing individual genes in genome-wide functional assay. Therefore, the combination of PGx and Cellular PGx is complementary to identify sub-populations responding / not responding to drug.
従来のPGxが、薬が効く人(レスポンダー)・効かない人(ノンレスポンダー)を遺伝マーカーを用いて判別するのに対し、細胞PGxでは、例えば、ある患者さん由来の初代培養細胞を用いて、その患者さんにa薬は効くのに、b薬は効かないのは「なぜ」かを明らかにします。これまでのPGxは、レスポンダーである患者さんに効く薬を処方する指針にはなりますが、ノンレスポンダーの患者さんに対しては何ら役に立ちません。しかし、ある薬剤に対してノンレスポンダーである患者さんは、レスポンダーの患者さんよりも常にはるかに多いのです。このような抗がん剤開発の現状に対して、当社の細胞PGxは、併合剤や適応拡大の設計によって、ノンレスポンダーである多くの患者さんにも使っていただける抗がん剤を探索する重要な役割を果たしていくものと考えております。
患者さんから得られた初代培養細胞に対し、例えば、候補化合物を3通りの投与量で7,000遺伝子(1つの遺伝子に対し4通りのsiRNAを使用)を用いてプロファイリングする場合、384フォーマットのウェルプレートでは、1ウェル当り3,000~5,000もの細胞が必要になってしまうため、実験を行うことは現実的ではありません。しかし、サイトパスファインダー社の技術によって、1536フォーマットで1ウェル当り300~500細胞、3456ウェルでは100~150細胞で実験ができるため、初代培養細胞のような希少な細胞資源を用いて統計学的に有意な十分な数のデータを得ることが、初めて現実のものとなったのです。